| Amylose AA : L'amylose AA est une forme d'amylose, une maladie caractérisée par le dépôt anormal de fibres de protéines insolubles dans l'espace extracellulaire de divers tissus et organes. Dans l'amylose AA, la protéine déposée est la protéine amyloïde A sérique (SAA), une protéine de phase aiguë qui est normalement soluble et dont la concentration plasmatique est la plus élevée pendant l'inflammation. | |
| Bêta amyloïde : Le bêta-amyloïde désigne des peptides de 36 à 43 acides aminés qui sont le principal composant des plaques amyloïdes présentes dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Les peptides dérivent de la protéine précurseur amyloïde (APP), qui est clivée par la bêta-sécrétase et la gamma-sécrétase pour produire Aβ dans un processus dépendant du cholestérol et une présentation du substrat. Les molécules Aβ peuvent s'agréger pour former des oligomères solubles flexibles qui peuvent exister sous plusieurs formes. On pense maintenant que certains oligomères mal repliés peuvent induire d'autres molécules Aβ à prendre également la forme oligomère mal repliée, conduisant à une réaction en chaîne semblable à une infection à prions. Les oligomères sont toxiques pour les cellules nerveuses. L'autre protéine impliquée dans la maladie d'Alzheimer, la protéine tau, forme également de tels oligomères mal repliés de type prion, et il existe des preuves qu'un Aβ mal replié peut induire un mauvais repliement de tau. |  |
| Bêta amyloïde : Le bêta-amyloïde désigne des peptides de 36 à 43 acides aminés qui sont le principal composant des plaques amyloïdes présentes dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Les peptides dérivent de la protéine précurseur amyloïde (APP), qui est clivée par la bêta-sécrétase et la gamma-sécrétase pour produire Aβ dans un processus dépendant du cholestérol et une présentation du substrat. Les molécules Aβ peuvent s'agréger pour former des oligomères solubles flexibles qui peuvent exister sous plusieurs formes. On pense maintenant que certains oligomères mal repliés peuvent induire d'autres molécules Aβ à prendre également la forme oligomère mal repliée, conduisant à une réaction en chaîne semblable à une infection à prions. Les oligomères sont toxiques pour les cellules nerveuses. L'autre protéine impliquée dans la maladie d'Alzheimer, la protéine tau, forme également de tels oligomères mal repliés de type prion, et il existe des preuves qu'un Aβ mal replié peut induire un mauvais repliement de tau. |  |
| Protéine précurseur bêta-amyloïde : La protéine précurseur bêta-amyloïde ( APP ) est une protéine membranaire intégrale exprimée dans de nombreux tissus et concentrée dans les synapses des neurones. Il fonctionne comme un récepteur de surface cellulaire et a été impliqué en tant que régulateur de la formation des synapses, de la plasticité neurale, de l'activité antimicrobienne et de l'exportation du fer. Il est codé par le gène APP et régulé par la présentation du substrat. L'APP est surtout connue comme la molécule précurseur dont la protéolyse génère le bêta-amyloïde (Aβ), un polypeptide contenant 37 à 49 résidus d'acides aminés, dont la forme fibrillaire amyloïde est le principal composant des plaques amyloïdes trouvées dans le cerveau des patients atteints de la maladie d'Alzheimer. |  |
| Bêta amyloïde : Le bêta-amyloïde désigne des peptides de 36 à 43 acides aminés qui sont le principal composant des plaques amyloïdes présentes dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Les peptides dérivent de la protéine précurseur amyloïde (APP), qui est clivée par la bêta-sécrétase et la gamma-sécrétase pour produire Aβ dans un processus dépendant du cholestérol et une présentation du substrat. Les molécules Aβ peuvent s'agréger pour former des oligomères solubles flexibles qui peuvent exister sous plusieurs formes. On pense maintenant que certains oligomères mal repliés peuvent induire d'autres molécules Aβ à prendre également la forme oligomère mal repliée, conduisant à une réaction en chaîne semblable à une infection à prions. Les oligomères sont toxiques pour les cellules nerveuses. L'autre protéine impliquée dans la maladie d'Alzheimer, la protéine tau, forme également de tels oligomères mal repliés de type prion, et il existe des preuves qu'un Aβ mal replié peut induire un mauvais repliement de tau. |  |
| Bêta amyloïde : Le bêta-amyloïde désigne des peptides de 36 à 43 acides aminés qui sont le principal composant des plaques amyloïdes présentes dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Les peptides dérivent de la protéine précurseur amyloïde (APP), qui est clivée par la bêta-sécrétase et la gamma-sécrétase pour produire Aβ dans un processus dépendant du cholestérol et une présentation du substrat. Les molécules Aβ peuvent s'agréger pour former des oligomères solubles flexibles qui peuvent exister sous plusieurs formes. On pense maintenant que certains oligomères mal repliés peuvent induire d'autres molécules Aβ à prendre également la forme oligomère mal repliée, conduisant à une réaction en chaîne semblable à une infection à prions. Les oligomères sont toxiques pour les cellules nerveuses. L'autre protéine impliquée dans la maladie d'Alzheimer, la protéine tau, forme également de tels oligomères mal repliés de type prion, et il existe des preuves qu'un Aβ mal replié peut induire un mauvais repliement de tau. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Cardiomyopathie amyloïde : La cardiomyopathie amyloïde est une affection entraînant la mort d'une partie du myocarde. Elle est associée à la production et à la libération systémiques de nombreuses protéines amyloïdogènes, en particulier la chaîne légère des immunoglobulines ou la transthyrétine (TTR). Elle peut être caractérisée par le dépôt extracellulaire d'amyloïdes, des protéines pliables qui se collent pour former des fibrilles dans le cœur. L'amyloïde peut être vu sous lumière polarisée dans la biopsie colorée en rouge Congo. | |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. | 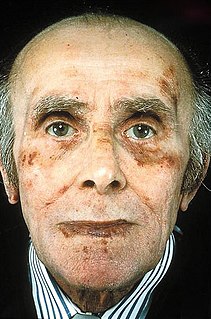 |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Biochimie de la maladie d'Alzheimer : La biochimie de la maladie d'Alzheimer , la cause la plus fréquente de démence, n'est pas encore très bien comprise. La maladie d'Alzheimer (MA) a été identifiée comme une protéopathie : une maladie du mauvais repliement des protéines due à l'accumulation de protéine bêta-amyloïde (Aβ) anormalement repliée dans le cerveau. La bêta-amyloïde est un peptide court qui est un sous-produit protéolytique anormal de la protéine précurseur bêta-amyloïde (APP) de la protéine transmembranaire, dont la fonction n'est pas claire mais qui serait impliquée dans le développement neuronal. Les présénilines sont des composants du complexe protéolytique impliqué dans le traitement et la dégradation de l'APP. | |
| Amylose AL : L' amylose à chaînes légères amyloïdes ( AL ), également connue sous le nom d'amylose primaire , est la forme la plus courante d'amylose systémique aux États-Unis. La maladie est causée lorsque les cellules productrices d'anticorps d'une personne ne fonctionnent pas correctement et produisent des fibres protéiques anormales constituées de composants d'anticorps appelés chaînes légères. Ces chaînes légères se rassemblent pour former des dépôts amyloïdes qui peuvent causer de graves dommages à différents organes. Les chaînes légères anormales dans l'urine sont parfois appelées "protéines de Bence Jones". | |
| Amylose rénale familiale : L'amylose rénale familiale est une forme d'amylose se présentant principalement dans le rein. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Neuropathie amyloïde familiale : Les neuropathies amyloïdes familiales sont un groupe rare de maladies autosomiques dominantes dans lesquelles le système nerveux autonome et/ou d'autres nerfs sont compromis par l'agrégation de protéines et/ou la formation de fibrilles amyloïdes. | |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Plaques amyloïdes : Les plaques amyloïdes sont des dépôts extracellulaires de la protéine bêta-amyloïde (Aβ) principalement dans la matière grise du cerveau. Des éléments neuronaux dégénératifs et une abondance de microglies et d'astrocytes peuvent être associés aux plaques amyloïdes. Certaines plaques apparaissent dans le cerveau à la suite de la sénescence (vieillissement), mais un grand nombre de plaques et d'enchevêtrements neurofibrillaires sont des caractéristiques de la maladie d'Alzheimer. Les neurites anormaux dans les plaques amyloïdes sont des axones et des dendrites tortueux et souvent enflés. Les neurites contiennent une variété d'organites et de débris cellulaires, et beaucoup d'entre eux comprennent des filaments hélicoïdaux appariés caractéristiques, la composante ultrastructurale des enchevêtrements neurofibrillaires. Les plaques sont de forme et de taille très variables; dans les coupes de tissus immunocolorées pour Aβ, elles comprennent une courbe de distribution de taille log-normale avec une surface moyenne de plaque de 400 à 450 micromètres carrés (µm²). Les plus petites plaques, qui sont souvent constituées de dépôts diffus d'Aβ, sont particulièrement nombreuses. La taille apparente des plaques est influencée par le type de colorant utilisé pour les détecter et par le plan à travers lequel elles sont sectionnées pour être analysées au microscope. Des plaques se forment lorsque Aβ se replie mal et s'agrège en oligomères et polymères plus longs, ces derniers étant caractéristiques de l'amyloïde. On pense que l'Aβ mal replié et agrégé est neurotoxique, en particulier dans son état oligomérique. |  |
| Plaques amyloïdes : Les plaques amyloïdes sont des dépôts extracellulaires de la protéine bêta-amyloïde (Aβ) principalement dans la matière grise du cerveau. Des éléments neuronaux dégénératifs et une abondance de microglies et d'astrocytes peuvent être associés aux plaques amyloïdes. Certaines plaques apparaissent dans le cerveau à la suite de la sénescence (vieillissement), mais un grand nombre de plaques et d'enchevêtrements neurofibrillaires sont des caractéristiques de la maladie d'Alzheimer. Les neurites anormaux dans les plaques amyloïdes sont des axones et des dendrites tortueux et souvent enflés. Les neurites contiennent une variété d'organites et de débris cellulaires, et beaucoup d'entre eux comprennent des filaments hélicoïdaux appariés caractéristiques, la composante ultrastructurale des enchevêtrements neurofibrillaires. Les plaques sont de forme et de taille très variables; dans les coupes de tissus immunocolorées pour Aβ, elles comprennent une courbe de distribution de taille log-normale avec une surface moyenne de plaque de 400 à 450 micromètres carrés (µm²). Les plus petites plaques, qui sont souvent constituées de dépôts diffus d'Aβ, sont particulièrement nombreuses. La taille apparente des plaques est influencée par le type de colorant utilisé pour les détecter et par le plan à travers lequel elles sont sectionnées pour être analysées au microscope. Des plaques se forment lorsque Aβ se replie mal et s'agrège en oligomères et polymères plus longs, ces derniers étant caractéristiques de l'amyloïde. On pense que l'Aβ mal replié et agrégé est neurotoxique, en particulier dans son état oligomérique. |  |
| Neuropathie amyloïde familiale : Les neuropathies amyloïdes familiales sont un groupe rare de maladies autosomiques dominantes dans lesquelles le système nerveux autonome et/ou d'autres nerfs sont compromis par l'agrégation de protéines et/ou la formation de fibrilles amyloïdes. | |
| Protéine précurseur bêta-amyloïde : La protéine précurseur bêta-amyloïde ( APP ) est une protéine membranaire intégrale exprimée dans de nombreux tissus et concentrée dans les synapses des neurones. Il fonctionne comme un récepteur de surface cellulaire et a été impliqué en tant que régulateur de la formation des synapses, de la plasticité neurale, de l'activité antimicrobienne et de l'exportation du fer. Il est codé par le gène APP et régulé par la présentation du substrat. L'APP est surtout connue comme la molécule précurseur dont la protéolyse génère le bêta-amyloïde (Aβ), un polypeptide contenant 37 à 49 résidus d'acides aminés, dont la forme fibrillaire amyloïde est le principal composant des plaques amyloïdes trouvées dans le cerveau des patients atteints de la maladie d'Alzheimer. |  |
| Sécrétase de la protéine précurseur bêta-amyloïde : Les sécrétases sont des enzymes qui "coupent" des morceaux d'une protéine plus longue qui est incrustée dans la membrane cellulaire. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Purpura amyloïde : Le purpura amyloïde est une affection caractérisée par des saignements sous la peau (purpura) chez certaines personnes atteintes d'amylose. Sa cause est inconnue, mais on pense que les défauts de coagulation causés par l'amyloïde y contribuent. |  |
| Amyloïde (mycologie): En mycologie, un tissu ou une caractéristique est dit amyloïde s'il présente une réaction amyloïde positive lorsqu'il est soumis à un test chimique brut utilisant de l'iode comme ingrédient du réactif de Melzer ou de la solution de Lugol, produisant une coloration bleue à bleu-noir. Le terme « amyloïde » est dérivé du latin amyloideus (« semblable à de l'amidon »). Il fait référence au fait que l'amidon donne une réaction similaire, également appelée réaction amyloïde. Le test peut porter sur des caractéristiques microscopiques, telles que les parois des spores ou des hyphes, ou l'appareil apical ou la paroi entière de l'asque d'un asque, ou être une réaction macroscopique sur un tissu où une goutte de réactif est appliquée. Les réactions négatives, appelées inamyloïdes ou non amyloïdes , concernent les structures qui restent jaune-brun pâle ou claires. Une réaction produisant une coloration rougeâtre foncé à brun rougeâtre est appelée réaction dextrinoïde ou réaction hémiamyloïde . | |
| Porpoloma umbrosum : Porpoloma umbrosum , communément appelé tricholome amyloïde , est une espèce de champignon de la famille des Tricholomataceae et l'espèce type du genre Porpoloma . Il a été décrit pour la première fois scientifiquement par les mycologues Alexander H. Smith et Maurice B. Walters en 1943 comme une espèce de Tricholoma . Rolf Singer l'a transféré à Porpoloma en 1962. Le champignon se trouve en Amérique du Nord, où il fructifie seul ou en petits groupes sous les conifères. Bien qu'il ressemble à l'espèce Tricholoma , il se distingue de ce genre par ses spores amyloïdes. |  |
| Bêta amyloïde : Le bêta-amyloïde désigne des peptides de 36 à 43 acides aminés qui sont le principal composant des plaques amyloïdes présentes dans le cerveau des personnes atteintes de la maladie d'Alzheimer. Les peptides dérivent de la protéine précurseur amyloïde (APP), qui est clivée par la bêta-sécrétase et la gamma-sécrétase pour produire Aβ dans un processus dépendant du cholestérol et une présentation du substrat. Les molécules Aβ peuvent s'agréger pour former des oligomères solubles flexibles qui peuvent exister sous plusieurs formes. On pense maintenant que certains oligomères mal repliés peuvent induire d'autres molécules Aβ à prendre également la forme oligomère mal repliée, conduisant à une réaction en chaîne semblable à une infection à prions. Les oligomères sont toxiques pour les cellules nerveuses. L'autre protéine impliquée dans la maladie d'Alzheimer, la protéine tau, forme également de tels oligomères mal repliés de type prion, et il existe des preuves qu'un Aβ mal replié peut induire un mauvais repliement de tau. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amylose : L'amylose est un groupe de maladies dans lesquelles des protéines anormales, appelées fibrilles amyloïdes, s'accumulent dans les tissus. Il existe plusieurs types avec des symptômes variables; les signes et symptômes peuvent inclure diarrhée, perte de poids, sensation de fatigue, hypertrophie de la langue, saignement, engourdissement, sensation de faiblesse en se tenant debout, gonflement des jambes ou hypertrophie de la rate. |  |
| Amyloïde : Les amyloïdes sont des agrégats de protéines caractérisés par une morphologie fibrillaire de 7 à 13 nm de diamètre, une structure secondaire en feuillets et une capacité à être colorés par des colorants particuliers, tels que le rouge Congo. Dans le corps humain, les amyloïdes ont été liés au développement de diverses maladies. Les amyloïdes pathogènes se forment lorsque des protéines auparavant saines perdent leur structure normale et leurs fonctions physiologiques (mauvais repliement) et forment des dépôts fibreux en plaques autour des cellules qui peuvent perturber le fonctionnement sain des tissus et des organes. |  |
| Amylolactobacille : Amylolactobacillus est un genre de bactéries lactiques. | |
| Leucopholiote : Leucopholiota est un genre de champignons de la famille des Tricholomataceae. Il se compose des espèces Leucopholiota decorosa et Leucopholiota lignicola . |  |
| Leucopholiote : Leucopholiota est un genre de champignons de la famille des Tricholomataceae. Il se compose des espèces Leucopholiota decorosa et Leucopholiota lignicola . |  |
| Processus amylolytique : Le processus amylolytique ou amylolyse est la conversion de l'amidon en sucre par l'action d'acides ou d'enzymes telles que l'amylase. | |
| Amylase : Une amylase est une enzyme qui catalyse l'hydrolyse de l'amidon en sucres. L'amylase est présente dans la salive des humains et de certains autres mammifères, où elle commence le processus chimique de digestion. Les aliments qui contiennent de grandes quantités d'amidon mais peu de sucre, comme le riz et les pommes de terre, peuvent acquérir un goût légèrement sucré lorsqu'ils sont mâchés car l'amylase dégrade une partie de leur amidon en sucre. Le pancréas et la glande salivaire fabriquent de l'amylase pour hydrolyser l'amidon alimentaire en disaccharides et trisaccharides qui sont convertis par d'autres enzymes en glucose pour fournir de l'énergie au corps. Les plantes et certaines bactéries produisent également de l'amylase. Les protéines amylases spécifiques sont désignées par différentes lettres grecques. Toutes les amylases sont des glycoside hydrolases et agissent sur les liaisons α-1,4-glycosidiques. | 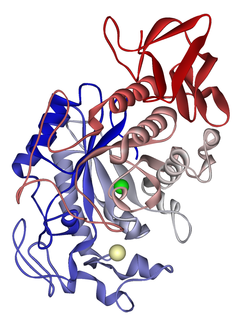 |
| Processus amylolytique : Le processus amylolytique ou amylolyse est la conversion de l'amidon en sucre par l'action d'acides ou d'enzymes telles que l'amylase. | |
| Amylomaize : Amylomaize était un terme inventé à la fin des années 1940 par Robert P. Bear de Bear Hybrids Corn Company à Decatur, Illinois pour décrire sa découverte et sa sélection commerciale d'un amidon de maïs à haute teneur en amylose (> 50 %), également appelé amidon à haute teneur en amylose. La découverte de l'amylomaize s'est produite comme une mutation dans une lignée pure normale; à partir de cette seule mutation, un tout nouveau type de maïs (maïs) a été développé. | |
| Méthylènedioxycathinone : La 3,4-méthylènedioxycathinone est un empathogène et un stimulant des classes de phénéthylamine, d'amphétamine et de cathinone et l'analogue β-céto du MDA. | 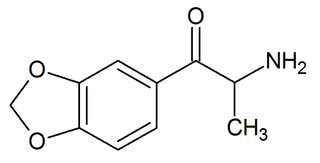 |
| Amylone : Amylonotus est un genre de champignons de la famille des Auriscalpiaceae. Il a été décrit pour la première fois par le mycologue norvégien Leif Ryvarden en 1975. | |
| Amyloodinium ocellatum : Amyloodinium ocellatum est un dinoflagellé ectoparasite cosmopolite de nombreux organismes aquatiques vivant dans des milieux saumâtres et marins. Le dinoflagellé est endémique dans les zones tempérées et tropicales, et est capable de s'adapter avec succès à une variété d'environnements différents et à un grand nombre d'hôtes, ayant été identifié dans quatre phylums d'organismes aquatiques : Chordata, Arthropoda, Mollusca et Platyhelminthes. De plus, c'est le seul dinoflagellé capable d'infecter les téléostéens et les élasmobranches. | |
| Amyloodinium ocellatum : Amyloodinium ocellatum est un dinoflagellé ectoparasite cosmopolite de nombreux organismes aquatiques vivant dans des milieux saumâtres et marins. Le dinoflagellé est endémique dans les zones tempérées et tropicales, et est capable de s'adapter avec succès à une variété d'environnements différents et à un grand nombre d'hôtes, ayant été identifié dans quatre phylums d'organismes aquatiques : Chordata, Arthropoda, Mollusca et Platyhelminthes. De plus, c'est le seul dinoflagellé capable d'infecter les téléostéens et les élasmobranches. | |
| Amylopectine : L'amylopectine est un polysaccharide soluble dans l'eau et un polymère hautement ramifié d'unités α-glucose que l'on trouve dans les plantes. C'est l'un des deux composants de l'amidon, l'autre étant l'amylose. |  |
| Limiter la dextrinase : La dextrinase limite est une enzyme portant le nom systématique dextrine 6-alpha-glucanohydrolase . Cette enzyme catalyse l'hydrolyse des liaisons (1->6)-alpha-D-glucosidiques dans les dextrines limites alpha et bêta de l'amylopectine et du glycogène, dans l'amylopectine et le pullulane. | |
| Amylo-alpha-1,6-glucosidase : L'amylo-alpha-1,6-glucosidase est une enzyme dont le nom systématique est la glycogène phosphorylase-limite dextrine 6-alpha-glucohydrolase . Cette enzyme catalyse la réaction chimique suivante
| |
| Pullulanase : La pullulanase est un type spécifique de glucanase, une exoenzyme amylolytique, qui dégrade le pullulane. Elle est produite sous forme de lipoprotéine extracellulaire ancrée à la surface cellulaire par des bactéries Gram-négatives du genre Klebsiella . Les pullulanases de type I attaquent spécifiquement les liaisons -1,6, tandis que les pullulanases de type II sont également capables d'hydrolyser les liaisons -1,4. Il est également produit par d'autres bactéries et archées. La pullulanase est utilisée comme auxiliaire technologique dans la biotechnologie de la transformation des grains. | |
| Amylopectine : L'amylopectine est un polysaccharide soluble dans l'eau et un polymère hautement ramifié d'unités α-glucose que l'on trouve dans les plantes. C'est l'un des deux composants de l'amidon, l'autre étant l'amylose. |  |
| Maladie de stockage du glycogène de type IV : La maladie de stockage du glycogène de type IV est une forme de maladie du stockage du glycogène, qui est causée par une erreur innée du métabolisme. C'est le résultat d'une mutation du gène GBE1, qui provoque un défaut de l'enzyme de ramification du glycogène. Par conséquent, le glycogène n'est pas fabriqué correctement et des molécules de glycogène anormales s'accumulent dans les cellules ; le plus sévèrement dans les cellules cardiaques et musculaires. La gravité de cette maladie varie en fonction de la quantité d'enzyme produite. La maladie de stockage du glycogène de type IV est autosomique récessive, ce qui signifie que chaque parent possède une copie mutante du gène mais ne présente aucun symptôme de la maladie. Elle affecte 1 personne sur 800 000 dans le monde, 3 % de toutes les maladies de stockage du glycogène étant de type IV. |  |
| Pica (trouble): Le pica est un trouble psychologique caractérisé par un appétit pour des substances largement non nutritives. La substance peut être biologique comme les cheveux (trichophagie) ou les matières fécales (coprophagie), naturelle comme la glace (pagophagie) ou la saleté (géophagie), et autrement chimique ou artificielle. Le terme vient du mot latin pica ("pie"), du concept selon lequel les pies mangent presque tout. |  |
| Amyloplaste : Les amyloplastes sont un type d'organites plastidiques à double enveloppe dans les cellules végétales qui sont impliqués dans diverses voies biologiques. Les amyloplastes sont spécifiquement un type de leucoplaste, une sous-catégorie des plastes incolores et ne contenant pas de pigment. Les amyloplastes se trouvent dans les racines et les tissus de stockage et stockent et synthétisent l'amidon pour la plante grâce à la polymérisation du glucose. La synthèse de l'amidon repose sur le transport du carbone depuis le cytosol, dont le mécanisme est actuellement débattu. | 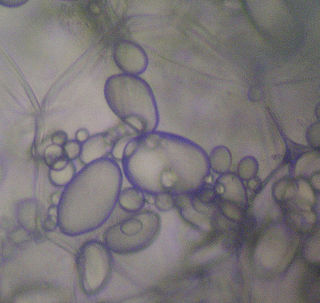 |
| Amyloplaste : Les amyloplastes sont un type d'organites plastidiques à double enveloppe dans les cellules végétales qui sont impliqués dans diverses voies biologiques. Les amyloplastes sont spécifiquement un type de leucoplaste, une sous-catégorie des plastes incolores et ne contenant pas de pigment. Les amyloplastes se trouvent dans les racines et les tissus de stockage et stockent et synthétisent l'amidon pour la plante grâce à la polymérisation du glucose. La synthèse de l'amidon repose sur le transport du carbone depuis le cytosol, dont le mécanisme est actuellement débattu. |  |
| Amyloporie : Amyloporia est un genre de cinq espèces de champignons de la croûte de la famille des Polyporaceae. Sa principale caractéristique distinctive est la réaction amyloïde des hyphes squelettiques, bien que certains auteurs ne la considèrent pas suffisante pour distinguer Amyloporia du genre apparenté Antrodia . | |
| Amyloporiella : Amyloporiella est un genre de champignons de la famille des Polyporaceae. | |
| Amylore : Amylora est un genre de champignons lichénisés de la famille des Trapeliaceae. Il s'agit d'un genre monotypique, contenant la seule espèce Amylora cervinocuprea . | |
| Amylore : Amylora est un genre de champignons lichénisés de la famille des Trapeliaceae. Il s'agit d'un genre monotypique, contenant la seule espèce Amylora cervinocuprea . | |
| Amylose : L'amylose est un polysaccharide constitué d'unités α- D- glucose, liées les unes aux autres par des liaisons glycosidiques (1→4). C'est l'un des deux composants de l'amidon, représentant environ 20 à 30 %. En raison de sa structure hélicoïdale serrée, l'amylose est plus résistante à la digestion que les autres molécules d'amidon et est donc une forme importante d'amidon résistant. |  |
| Amylosporomyces : Amylosporomyces est un genre de champignons de la famille des Stéréacées. | |
| Amylospore : Amylosporus est un genre de champignons de la famille des Bondarzewiaceae. Le genre comprend cinq espèces largement réparties dans les régions tropicales. | |
| Amylostère : Amylostereum est le genre unique de la famille fongique des Amylostereaceae . Le genre comprend actuellement quatre espèces saprotrophes et parasites, qui vivent de bois vivant ou mort. Les Amylostéréacées provoquent la pourriture blanche du bois en désintégrant la lignine, composant des tissus. Ils produisent des corps fruitiers en forme de croûte et partiellement ondulés à la surface des arbres infestés, qui sont similaires à ceux produits par les espèces Stereum . |  |
| Amylostère : Amylostereum est le genre unique de la famille fongique des Amylostereaceae . Le genre comprend actuellement quatre espèces saprotrophes et parasites, qui vivent de bois vivant ou mort. Les Amylostéréacées provoquent la pourriture blanche du bois en désintégrant la lignine, composant des tissus. Ils produisent des corps fruitiers en forme de croûte et partiellement ondulés à la surface des arbres infestés, qui sont similaires à ceux produits par les espèces Stereum . |  |
| Amylostereum areolatum : Amylostereum areolatum est une espèce de champignon de la croûte. Initialement appelée Thelephora areolata en 1828, elle a reçu son nom actuel du mycologue français Jacques Boidin en 1958. |  |
| Amylostereum chailletii : Amylostereum chailletii est une espèce de champignon de la croûte. Il a été décrit à l'origine en 1822 sous le nom de Thelephora chailletii par Christian Hendrik Persoon en 1822, et a reçu son nom actuel lorsqu'il a été transféré à Amylostereum par Jacques Boidin en 1958. Il provoque une pourriture blanche, en particulier chez les espèces d'épinette et de sapin. |  |
| Amylostereum ferreum : Amylostereum ferreum est une espèce de champignon de la croûte de la famille des Amylostereaceae. | |
| Amylostereum laevigatum : Amylostereum laevigatum est une espèce de champignon de la croûte de la famille des Amylostereaceae. Initialement nommé Thelephora laevigata par Elias Fries en 1828, il a reçu son nom actuel lorsqu'il a été transféré dans le genre Amylostereum par le mycologue français Jacques Boidin en 1958. |  |
| Peniophora sacrata : Peniophora sacrata est une espèce de champignon de la famille des Peniophoraceae. Pathogène végétal, le champignon provoque le chancre des racines et des tiges de Peniophora sur les pommiers. | |
| Amylosaccharase : En enzymologie, une amylosaccharase est une enzyme qui catalyse la réaction chimique
| |
| Amylothèque : Amylotheca est un genre d'arbustes arial hémi-parasites de la famille des Loranthaceae, que l'on trouve à Bornéo, en Malaisie, en Nouvelle-Calédonie, en Nouvelle-Guinée, en Australie, à Sumatra, en Thaïlande, au Vanuatu et aux Philippines. |  |
| Signification des noms de planètes mineures : 9001-10000 : | |
| Amyloxénasme : Amyloxenasma est un genre de champignons corticoïdes de la famille des Amylocorticiaceae. Le genre largement distribué contient six espèces. |  |
| Olivetol : L'olivetol , également connu sous le nom de 5-pentylrésorcinol ou 5-pentyl-1,3-benzènediol , est un composé organique présent dans certaines espèces de lichen ; c'est aussi un précurseur dans diverses synthèses de tétrahydrocannabinol. |  |
| Nitrite d'amyle : Le nitrite d'amyle est un composé chimique de formule C 5 H 11 ONO. Une variété d'isomères sont connus, mais ils comportent tous un groupe amyle attaché au groupe fonctionnel nitrite. Le groupe alkyle n'est pas réactif et les propriétés chimiques et biologiques sont principalement dues au groupe nitrite. Comme les autres nitrites d'alkyle, le nitrite d'amyle est bioactif chez les mammifères, étant un vasodilatateur, ce qui est à la base de son utilisation en tant que médicament d'ordonnance. En tant qu'inhalant, il a également un effet psychoactif, ce qui a conduit à son utilisation récréative avec son odeur décrite comme celle de vieilles chaussettes ou de pieds sales. Il est également appelé gaz banapple . |  |
| Amitriptyline : L'amitriptyline , vendue entre autres sous le nom de marque Elavil , est un antidépresseur tricyclique principalement utilisé pour traiter le trouble dépressif majeur et une variété de syndromes douloureux allant de la douleur neuropathique à la fibromyalgie en passant par la migraine et les céphalées de tension. En raison de la fréquence et de l'importance des effets secondaires, l'amitriptyline est généralement considérée comme un traitement de deuxième intention pour ces indications. |  |
| Amidon: L'amidon ou l' amylum est un glucide polymère constitué de nombreuses unités de glucose reliées par des liaisons glycosidiques. Ce polysaccharide est produit par la plupart des plantes vertes pour le stockage d'énergie. Dans le monde entier, c'est le glucide le plus courant dans l'alimentation humaine et il est contenu en grande quantité dans les aliments de base comme les pommes de terre, le maïs (maïs), le riz, le blé et le manioc (manioc). |  |
| Signification des noms de planètes mineures : 10001–11000 : | |
| Harpalykos : Dans la mythologie grecque, le nom Harpalycus peut faire référence à :
| |
| Signification des noms de planètes mineures : 22001–23000 : | |
| Amymome : Amymoma pulchella est une espèce de coléoptère de la famille des Cerambycidae, et la seule espèce du genre Amymoma . Il a été décrit par Francis Polkinghorne Pascoe en 1866. | |
| Amymome : Amymoma pulchella est une espèce de coléoptère de la famille des Cerambycidae, et la seule espèce du genre Amymoma . Il a été décrit par Francis Polkinghorne Pascoe en 1866. | |
| Amymone : Dans la mythologie grecque, Amymone était une fille de Danaus, roi de Libye et d'Europe, une reine. En tant que Danaïd « irréprochable », son nom l'identifie comme, peut-être, identique à Hypermnestra, également la seule Danaïd qui n'a pas assassiné son mari égyptien lors de leur nuit de noces, comme l'ont fait ses 49 sœurs. L'auteur de la Bibliotheca , dans sa liste de noms pour les Danaïdes, mentionne cependant à la fois Hypermnestre et Amymone. |  |
| Les Suppliants (Eschyle) : Les suppliantes , également appelées les filles suppliantes , les femmes suppliantes ou supplices, est une pièce d'Eschyle. Il a probablement été joué pour la première fois "quelques années seulement avant l' Orestea , qui a été présenté en 458 av. Il semble que ce soit la première pièce d'une tétralogie, parfois appelée la tétralogie de Danaïde , qui comprenait probablement les pièces perdues Les Égyptiens et Les Filles de Danaus , et la pièce de satyre Amymone . On a longtemps pensé que c'était la première pièce survivante d'Eschyle en raison de la fonction relativement anachronique du chœur en tant que protagoniste du drame. Cependant, des preuves découvertes au milieu du 20e siècle montrent qu'il s'agit de l'une des dernières pièces d'Eschyle, certainement après Les Perses et peut-être après Sept contre Thèbes .
|  |
| Amymusu Jones : Amymusu K. Jones est une juriste libérienne et la première femme nommée magistrate de la Cour de magistrat de Monrovia en 1994 et a été la plus longue juge de circuit du comté de Grand Cape Mount. Elle a pris sa retraite en 2018 et est décédée 30 jours plus tard. |  |
| Amyn Aga Khan : Le prince Amyn Muhammad Aga Khan est le frère cadet d'Aga Khan IV, imam de la secte Nizari Isma'ili de l'Islam chiite. Il est le fils du prince Aly Khan et de la princesse Tajuddawlah Aga Khan. |  |
| Amyn Aga Khan : Le prince Amyn Muhammad Aga Khan est le frère cadet d'Aga Khan IV, imam de la secte Nizari Isma'ili de l'Islam chiite. Il est le fils du prince Aly Khan et de la princesse Tajuddawlah Aga Khan. |  |
| Amyna : Amyna est un genre de papillons nocturnes de la famille des Noctuidae érigé par Achille Guenée en 1852. |  |
| Amyna amplificans : Amyna amplificans est un papillon nocturne de la famille des Noctuidae décrit pour la première fois par Francis Walker en 1858. On le trouve au Guatemala, au Costa Rica et au Venezuela. Un seul spécimen a été collecté dans les montagnes Huachuca dans le sud-est de l'Arizona. |  |
| Amyna apicalis : Amyna apicalis est un papillon nocturne de la famille des Noctuidae. On le trouve dans le Queensland. | |
| Osiriaca : Osiriaca est un genre de papillon monotypique de la famille des Crambidae décrit par Francis Walker en 1866. Sa seule espèce, Osiriaca ptousalis , décrite par le même auteur en 1859, est connue d'Australie. |  |
| Axe Amyna : Amyna axis , le huit-tache , est un papillon de la famille des Noctuidae. L'espèce a été décrite pour la première fois par Achille Guenée en 1852. | |
| Amyna bullula : Amyna bullula , la teigne amyna à pointe crochue , est une espèce de mite de la famille des Noctuidae. On le trouve en Amérique du Nord. | |
| Axe Amyna : Amyna axis , le huit-tache , est un papillon de la famille des Noctuidae. L'espèce a été décrite pour la première fois par Achille Guenée en 1852. | |
| Amyna natalis : Amyna natalis , le papillon ilima , est un papillon de la famille des Noctuidae. Il a été décrit pour la première fois par Francis Walker en 1858. Il est répandu de l'Asie tropicale jusqu'au nord de l'Australie. C'est une espèce introduite à Hawaï, où on la trouve à Oahu. | |
| Axe Amyna : Amyna axis , le huit-tache , est un papillon de la famille des Noctuidae. L'espèce a été décrite pour la première fois par Achille Guenée en 1852. | |
| Amyna punctum : Amyna punctum est un papillon de la famille des Noctuidae décrit pour la première fois par Johan Christian Fabricius en 1794. Ce papillon peut être trouvé dans tous les pays d'Afrique subtropicale tels que l'Afrique du Sud, Madagascar et les pays d'Australasie comme l'Inde, le Sri Lanka, les Philippines, Bornéo et les îles Andaman. . |  |
| Amyna punctum : Amyna punctum est un papillon de la famille des Noctuidae décrit pour la première fois par Johan Christian Fabricius en 1794. Ce papillon peut être trouvé dans tous les pays d'Afrique subtropicale tels que l'Afrique du Sud, Madagascar et les pays d'Australasie comme l'Inde, le Sri Lanka, les Philippines, Bornéo et les îles Andaman. . |  |
| Amyna punctum : Amyna punctum est un papillon de la famille des Noctuidae décrit pour la première fois par Johan Christian Fabricius en 1794. Ce papillon peut être trouvé dans tous les pays d'Afrique subtropicale tels que l'Afrique du Sud, Madagascar et les pays d'Australasie comme l'Inde, le Sri Lanka, les Philippines, Bornéo et les îles Andaman. . |  |
| Axe Amyna : Amyna axis , le huit-tache , est un papillon de la famille des Noctuidae. L'espèce a été décrite pour la première fois par Achille Guenée en 1852. | |
| Amynanda : Amynanda était une ville de l'ancienne Carie. Amynanda apparaît dans les listes de tribut athéniennes et a payé un tribut annuel de 50 drachmes, 5 oboles. | |
| Amynanda : Amynanda était une ville de l'ancienne Carie. Amynanda apparaît dans les listes de tribut athéniennes et a payé un tribut annuel de 50 drachmes, 5 oboles. | |
| Amynandre : Amynander ou Amynandros peut désigner :
| |
| Amynandre : Amynander ou Amynandros peut désigner :
| |
| Amynandre d'Athamanie : Amynander était roi des Athamanes dans le sud de l'Épire, à la suite de son prédécesseur Théodore d'Athamanie. Il était un beau-frère du roi illyrien Scerdilaidas et apparaît pour la première fois dans l'histoire en tant que médiateur entre Philippe V de Macédoine et les Étoliens. | |
| Amynanda : Amynanda était une ville de l'ancienne Carie. Amynanda apparaît dans les listes de tribut athéniennes et a payé un tribut annuel de 50 drachmes, 5 oboles. | |
| Amynandre d'Athamanie : Amynander était roi des Athamanes dans le sud de l'Épire, à la suite de son prédécesseur Théodore d'Athamanie. Il était un beau-frère du roi illyrien Scerdilaidas et apparaît pour la première fois dans l'histoire en tant que médiateur entre Philippe V de Macédoine et les Étoliens. | |
| Amyntaio : Amyntaio , connue avant 1928 sous le nom de Sorovich , est une ville et une municipalité de l'unité régionale de Florina en Macédoine, en Grèce. La population d'Amyntaio proprement dite est de 4 306, tandis que celle de l'ensemble de la municipalité est de 16 973 (2011). La ville porte le nom de l'ancien roi de Macédoine et grand-père d'Alexandre le Grand, Amyntas III. |  |
| Unima : Unima est la plus grande entreprise de Madagascar et un acteur de premier plan dans le commerce international des produits de la mer. |  |
| Unima : Unima est la plus grande entreprise de Madagascar et un acteur de premier plan dans le commerce international des produits de la mer. |  |
| Amynilyspes : Amynilyspes est un genre éteint de mille-pattes en pilule caractérisé par quatorze tergites, de grands yeux et des épines proéminentes. Les individus mesurent jusqu'à 30 mm (1,2 po) de longueur. |  |
| Amynilyspes : Amynilyspes est un genre éteint de mille-pattes en pilule caractérisé par quatorze tergites, de grands yeux et des épines proéminentes. Les individus mesurent jusqu'à 30 mm (1,2 po) de longueur. |  |
| Pilule de mille-pattes : Les mille - pattes pilules sont des membres de deux ordres vivants de mille-pattes, souvent regroupés en un seul super-ordre, Oniscomorpha . Le nom Oniscomorpha fait référence à la ressemblance des mille-pattes avec certains cloportes (Oniscidea), également appelés pillbugs ou « roly-polies ». Cependant, les mille-pattes et les cloportes ne sont pas étroitement liés ; il s'agit plutôt d'un cas d'évolution convergente. |  |
| Amynilyspes : Amynilyspes est un genre éteint de mille-pattes en pilule caractérisé par quatorze tergites, de grands yeux et des épines proéminentes. Les individus mesurent jusqu'à 30 mm (1,2 po) de longueur. |  |
| mynnet : Åmynnet est une localité située dans la municipalité d'Örnsköldsvik, dans le comté de Västernorrland, en Suède avec 340 habitants en 2010. |  |
Chủ Nhật, 19 tháng 9, 2021
AA amyloidosis, Amyloid beta, Amyloid beta
Đăng ký:
Đăng Nhận xét (Atom)

Không có nhận xét nào:
Đăng nhận xét